
Наследственными тромбофилиями называются состояния, при которых существует риск возникновения и рецидивирования тромбозов кровеносных сосудов (преимущественно венозных) различной локализации, в том числе в молодом возрасте, при этом степень выраженности риска зависит от конкретного вида генетического дефекта системы гемостаза, обусловившего нарушения состава и свойств крови.
Риск осложнений беременности при наследственных тромбофилиях (31)
Система гемостаза, как известно, является полифункциональной и многокомпонентной, ответственной не только за регуляцию агрегатного состояния крови (реологическая, антитромботическая, гемостатическая, фибринолитическая функции), но и обладающей протективной, ангиотрофической, репаративной функциями. Поэтому система гемостаза реагирует на воздействие любых экзогенных и/или эндогенных факторов и отражает любое неблагополучие организма.
В течение беременности тромбогенный потенциал крови повышается в связи с физиологическими изменениями некоторых компонентов системы гемостаза, ведущих к гиперкоагуляции (23), а именно:
- повышением резистентности к активированному протеину С во II и III триместре;
- снижением активности протеина S вследствие уменьшения общего количества протеина S под действием эстрогенов и повышения уровней протеина, связывающего компонент комплемента 4b, который взаимодействует с протеином S;
- повышением уровней фибриногена и факторов II, VII, VIII и X;
- увеличением уровней и активности ингибиторов фибринолиза, активируемого тромбином ингибитора фибринолиза (TAFI), PAI-1 и PAI-2.
На фоне замедленного кровотока вследствие гормональных, механических воздействий подобные изменения нарушают функциональное равновесие всех звеньев системы гемостаза и создают предпосылки к тромботическим состояниям.
Даже при физиологическом течении беременности приблизительно в 6 раз повышается риск венозных тромбоэмболий за счет обструкции венозного возврата растущей маткой, венозной атонии.
Нормализация параметров системы гемостаза происходит в течение 4–6 недель после родов (8).
Понятно, что в условиях индуцированной беременностью гиперкоагуляции вклад генетически обусловленных тромбофилических дефектов гемостаза становится более значимым.
Семейные случаи венозных тромбозов и тромбоэмболий были описаны еще в самом начале XX века. Однако только с развитием молекулярной биологии и детального изучения системы гемостаза и фибринолиза реализовались исследования в этом направлении и подтвердили гениальное предположение Рудольфа Вирхова (1856) о том, что сама кровь и ее компоненты могут обусловливать тромбоэмболические осложнения.
Однако, несмотря на относительно невысокую частоту носительства среди европейцев (8–15%), перечисленные наследственные дефекты гемостаза в какой-то мере обуславливают до половины случаев материнских венозных тромбозов и тромбоэмболий. Так, около 40% тромбоэмболий и около 30% акушерских осложнений связаны с наследственными тромбофилиями (17).
Согласно данным А.Д. Макацария и соавт. (2003), наследственные формы тромбофилии среди причин привычной потери беременности составляют 10–30%. По данным Coulam С.B. и соавт.
(2006) (9) наследственные тромбофилии имеют значение, только в тех случаях, когда имеется 3 и более мутации, причем гомозиготная мутация принимается за две мутации, а гетерозиготная считается как одна.
Среди генетически обусловленных тромбогенных дефектов гемостаза наибольшее значение имеют резистентность к активированному протеину С (АРС резистентность) в результате гетерозиготной мутации гена фактора V (Leiden) (FVL) mutation, повышение протромбиновой активности, связанной с гетерозиготной мутацией гена протромбина G20210A. Отдельная роль принадлежит мутации гена MTHFR и гипергомоцистеинемии. Меньшую роль играют дефицит антитромбина III, дефицит протеинов C и S.
Механизмы реализации наследственной тромбофилии при потере беременности точно не установлены.
Необходимо также подчеркнуть связь свертывающей, противосвертывающей и фибринолитической систем организма с иммунной и кинин-калликреиновой системой, системой комплемента, факторами ангиогенеза и воспаления (6), которые претерпевают значительную перестройку во время беременности и могут вовлекаться в процессы патогенеза невынашивания беременности при разных формах тромбофилии.
Активированный протеин С (АРС) ингибирует факторы свертывания VIII (при участии протеина S) и V путем протеолитического расщепления. Особую роль он играет в предотвращении тромбообразования в неповрежденных сосудах.
Лейденская мутация обусловливает устойчивость молекулы фактора V к протеолитическому воздействию АРС; передается по аутосомно-доминантному типу.
Средняя популяционная частота гетерозиготной мутации гена FV (Leiden) составляет 3–7% среди европейцев; в 18–20% она ответственна за развитие венозных тромбоэмболических осложнений (7). Случаи гомозиготного носительства данной мутации чрезвычайно редки.
АРС-резистентность может вызывать различные симптомы тромбоза; наиболее часто – тромбоз глубоких вен; встречается у 3–7% европейцев и у 20–30% пациентов с тромбозами. Хотя APC-резистентность может быть приобретенной, например, при антифосфолипидном синдроме, в большинстве случаев она связана с мутацией фактора V (FVL).
Новая генетика (геномика) в профилактике осложнений беременности
Загляните внутрь себя! Исследуйте свой геном! Обследование в Лаборатории ЦИР: Исследование крови на наследственные дефекты гемостаза (полиморфизмы генов системы гемостаза)
Особенностью многих вариантных генов является то, что они могут долгое время никак себя не проявлять. Патологические симптомы могут возникнуть при дополнительных условиях (особенности питания, беременность, прием лекарств, образ жизни и т. д.). Выяснение этих дополнительных условий помогает эффективно предотвращать развитие заболеваний и их осложнений у носителей вариантных генов.
Тромбофилия как фактор риска осложнений беременности
Тромбофилией называется склонность к развитию тромбов (кровяных сгустков). Тромбофилия может быть угрожающим жизни состоянием, если тромб запирает кровоток.
Тромбофилия может быть наследственным нарушением, но может быть связана и с внешними причинами, такими как хирургические операции, ожирение, беременность, использование гормональных контрацептивов, антифосфолипидный синдром, повышение уровня гомоцистеина или долгий период неподвижности.
Врачи подозревают наличие тромбофилии у пациентов, имевших тромбозы в прошлом, или у родственников которых были случаи тромбозов, инсультов, инфарктов в молодом возрасте (до 40 — 50 лет). Однако у многих людей с тромбофилией нет никаких симптомов, или эти симптомы проходят незамеченными, поскольку тенденция к тромбофилии недостаточно сильно выражена.
Исследования последних лет показали, что наличие тромбофилии сопряжено с повышенным риском развития осложнений беременности (привычное невынашивание, плацентарная недостаточность, задержка роста плода, поздний токсикоз (гестоз)). К числу генных маркеров наследственных тромбофилий относятся мутация метилентетрагидрофолатредуктазы, лейденская мутация и мутация гена протромбина G20210A.
Исследования последних лет показали, что у пациенток с привычным невынашиванием беременности часто обнаруживаются один или несколько генетических маркеров тромбофилии. Например, в одном из исследований было обнаружено наличие лейденской мутации у 19% пациенток с невынашиванием беременности, тогда как в контрольной группе лейденская мутация была обнаружена только у 4% женщин.
Мутация метилентетрагидрофолат-редуктазы
фермента с нарушениями обмена гомоцистеина. Примерно в те же годы было показано, что повышение уровня гомоцистеина является независимым фактором риска развития сосудистых осложнений. Начались попытки выяснения генетической природы дефицита MTHFR. Клонирование гена MTHFR в 1993 г. стало основой для определения мутаций, связанных с различными степенями дефицита данного фермента.
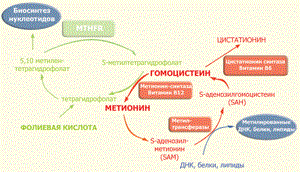
Фолатный цикл
Фермент 5,10-метилентетрагидрофолат-редуктаза относится к группе флавопротеинов и состоит из двух одинаковых субъединиц с молекулярной массой около 70 кДа. MTHFR является ключевым ферментом фолатного цикла.
Фолат и фолиевая кислота (синтетический витамин, отсутсвующий в естественных продуктах) являются двумя формами семейства веществ, связанных с птероилглютаминовой кислотой (ПтеГлу). Эта кислота является сложной молекулой, состоящей из птероидной кислоты и одного (моноглютаматы) или нескольких (до 9, полиглютаматы) остатков глютаминовой кислоты (см. рис. 1).
Пища, особенно свежая зелень, печень, дрожжи и некоторые фрукты в основном содержат восстановленные полиглютаматы, которые должны быть гидролизованы с помощью фермента птероилполиглютамат-гидролазы до моноглютамата, чтобы они могли быть абсорбированы в проксимальном отделе тонкого кишечника.
После всасывания фолат-моноглютамат быстро восстанавливается до тетрагидрофолата, поскольку только восстановленные формы фолата обладают биологической активностью. После метилирования фолаты поступают в кровь в виде 5-метилтетрагидрофолата.
Кроме пищи, постоянное поступление 5-метилтетрагидрофолата обеспечивается кишечно-печеночным циклом: птерил-моноглютамат всасывается из кишечника и поступает в печень, где он восстанавливается и метилируется до 5-метилтетрагидрофолата. Образовавшийся 5-метилтетрагидрофолат выделяется с желчью в кишечник, где он затем всасывается и разносится с кровью по всему организму.
| Рис. 1. Фолатный цикл и цикл метионина. |
В ткани поступление 5-метилтетрагидрофолата внутрь клетки происходит с помощью эндоцитоза при участии специфических фолатных рецепторов. Описаны три изоформы фолатных рецепторов. Внутри клетки 5-метилтетрагидрофолат служит донором метильных групп и основным источником тетрагидрофолата.
Последний выступает в качестве акцептора большого числа моноуглеродных групп, превращаясь в разные виды фолатов, служащих в свою очередь специфическими коферментами в целом ряде внутриклеточных реакций.
К ним относятся 5-формилтетрагидрофолат (фолиниевая кислота, лейковорин), 10-формилтетрагидрофолат и 5,10-метилентетрагидрофолат.
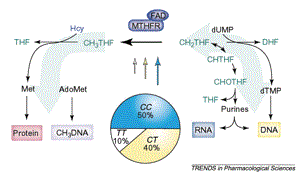
Одной из реакций, требующих наличия 5,10-метилентетрагидрофолата и 5-метилтетрагидрофолата, является синтез метионина из гомоцистеина (путь реметилирования в обмене гомоцистеина).
В этой реакции MTHFR играет ключевую роль, восстанавливая 5,10-метилентетрагидрофолат до 5-метилтетрагидрофолата, являясь таким образом катализатором единственной внутри клетки реакции образования 5-метилтетрагидрофолата.
Хотя в сыворотке и других тканевых жидкостях обнаруживаются разные формы фолатов, главной формой фолата в плазме является 5-метилтетрагидрофолат, несущий на себе метильную группу, необходимую для превращения гомоцистеина в метионин.
В этой реации метильная группа вначале переносится на коб(I)аламин (форма витамина B12), превращая его в метилкобаламин, который затем отдает метильную группу гомоцистеину, образуя метионин с помощью фермента метионин-синтазы. Однако в некоторых случаях коб(I)аламин может окисляться в коб(II)аламин, что приводит к подавлению метионин-синтазы. Для поддержания активности фермента необходимо восстановительное метилирование с помощью фермента метионин-синтаза-редуктазы.
Поскольку кобаламин (витамин B12) служит акцептором метильной группы 5-метилтетрагидрофолата, дефицит этого витамина приводит к «ловушке для фолата».
Это тупиковый путь метаболизма, поскольку метилтетрагидрофолат не может при этом восстанавливаться до тетрагидрофолата и возвращаться в фолатный пул.
Неспособность регенирировать метионин приводит к истощению запаса метионина и выбросу в кровь избытка гомоцистеина.
Тромбофилическое состояние, обусловленное мутацией генов (pai-1, mthfr) — успехи современного естествознания (научный журнал)
1
Толеуова А.С. 1
Тайжанова Д.Ж. 1
Гусеинова З.К. 1
Жексембаева С.О. 1
1 Карагандинский государственный медицинский университет
Проведены описание и анализ клинического случая: тромбофилии у больного, поступившего в стационар с клиникой желудочно-кишечного кровотечения.
В ходе обсуждения были рассмотрены современные подходы в лечении такого рода больных.
ингибитор активации плазминогена
1. Капустин С.И. Наследственная тромбофилия, как полигенная.патология // Тромбоз, гемостаз и реология. – 2006. – № 2 (26). – С. 24–34.
2. Папаян Л.П. Современное представление о механизме регуляции свертывания крови. Тромбоз, гемостаз и реология.
– 2004. – № 2. – С. 7–11.
3. Фаучи Э., Браунвальд Ю., Иссельбахер К. и др. Внутренние болезни по Тинсли Р. Харрисону. – М.: Практика, 2002. – С. 577.
4. Schnyder G., Roffi M., Flammer Y. et al.
Effect of homocysteine-lowering therapy with folic acid, vitamin B12, and vitamin B6 on clinical outcome after percutaneous coronary intervention: the Swiss Heart Study: A Randomized Controlled Trial. JAMA 2002; 288:973–979.
5. Willems H.P., den Heijer M., Bos G.M. VITRO: The vitamins and Thrombosis Trial. Semin Thromb Hemost. (US) 2000; 26:3:297–304.
Тромбофилическое состояние это многочисленные нарушения в системе гемостаза, которые обуславливают повышенную склонность к развитию тромбозов кровеносных сосудов различного калибра и локализации [1]. Клиническому проявлению тромбоза предшествует состояние, характеризующееся повышенным риском развития неконтролируемого патологического тромбообразования [2].
Наличие тромбофилии не означает фатальной неизбежности развития тромбоза, однако значительная часть лиц с таким состоянием испытывает в течение жизни те или иные тромботические проявления и их осложнения в виде острого инфаркта миокарда, ишемии мозга, тромбозов вен и артерий и т.д.
В 1965 г. О. Эгеберг впервые описал норвежскую семью, в которой склонность к венозным тромбозам наблюдалась на протяжении нескольких поколений. В этой семье тромботические явления были отмечены в молодом возрасте.
Изучение крови больных позволило обнаружить выраженное уменьшение (на 40–50 %) антитромбина III. Позднее Г. Шаш в своих исследованиях показал возможность различных форм дефекта антитромбина III, который встречается довольно часто.
У людей с повторными тромбозами его выявляли в 5–7 %. Среди здоровых лиц его выявляют у 1 на 5000 обследованных.
Состояние тромбофилии изучается достаточно интенсивно во многих клиниках мира. В настоящее время обнаружены дефекты в генах следующих факторов свертывания крови, приводящие к наследственным тромбофилиям:
1. Антитромбин III (полное отсутствие или изменение количества).
2. Протеин С (полное отсутствие или изменение количества).
3. Протеин S.
4. Кофактор гепарина II.
5. Фибриноген.
6. Плазминоген.
7. Активатор плазминогена (t-РА).
8. Фактор Хакемана.
9. Факторы тромбоцитов.
10. Простациклин.
11. АРС-резистентность фактора V.
12. Гомоцистеинемия.
Описание случая
Больной Анатолий Васильевич, 1957 года рождения (56 лет), поступил в клинику 6 декабря 2012 года с признаками желудочно-кишечного кровотечения (черный стул, головокружение). Помимо этого больной предъявлял жалобы на головные боли, сердцебиение, слабость.
Из анамнеза: в апреле 2011 перенес острый инфаркт миокарда, было сделано стентирование передней нисходящей артерии. Из лекарств, принимает зилт 75 постоянно. Хартил, конкор периодически. В июне 2011 г. В связи с потерей сознания, вызвал уч.
терапевта, был консультирован невропатологом на дому, лечился сосудистыми препаратами. При обследовании на МРТ головного мозга выявлено ОНМК в лобно-теменной области справа. В октябре 2011 г. обследовался в г. Барнаул, Российской Федерации.
Из обследования в гематологическом центре г. Барнаул (РФ)
| Ген метиленгидрофолат редуктазы (МТНFR) C677 – Т | Гетерозигота |
| Ген метиленгидрофолат редуктазы (МТНFR) А 1298 – С (Е429А) | – |
| Ген V фактора (F V) G1691 – А (Лейденовская – Arg506Gln) | Норма |
| Ген протромбина (F II) G 20210 – A | Норма |
| Ген гликопротеина IIIa (β3 – интегрин) 1565 Т > С (L33Р) | – |
| Ген метионин-синтетазы редуктазы (МТRR) А66– G (122M) | – |
| Ген гликопротеина (VLA-2 receptor) ITGA2: 807 С > Т (F224F) | |
| Ген метионин-синтетазы (МТR) А2756– G (D 919G) | – |
| Ген снижающий концентрацию фолатов (RFCI) G80– А | – |
| Ген АСЕ (ангиотензинпревращающий фермент (I/D) | – |
| Ген ингибитора активатора плазминогена (PAI-1) 4G/5G | гомозигота |
| Ген фактор I (F I), фибриноген, β субъединица F I? FGB:455 G > А | Норма |
| Антитела к кардиолипину | Отр. |
| Антитела к β2- GР-1 | Отр. |
| Уровень гомоцистеина в крови, мкмоль/л | 13,1 |
Заключение. Тромбофилическое состояние, обусловленное гомозиготной мутацией гена, ответственного за синтез PAI-1 и гетерозиготной мутацией гена МТНFR (С677 – Т).
Больной неоднократно получает стационарное и амбулаторное лечение, при этом постоянно получает антикоагулянты и дезагреганты. Настоящее ухудшение состояния наступило 6.12.12 г., у больного появляется клиника желудочно-кишечного кровотечения в связи с чем, больной был госпитализирован в хирургическое отделение.
Объективно: состояние пациента средней степени тяжести. Кожные покровы обычной окраски. ЧДД-20 в минуту. Тоны сердца приглушены, ритм правильный. Пульс – 100 в минуту. АД-120 и 80 мм рт. ст.
Язык суховат, обложен бурым налетом. Живот при пальпации мягкий, умеренно болезненный в эпигастральной области. Симптомов раздражения брюшины нет. Печень не увеличена. Перитонеальных симптомов нет. Кал черного цвета.
Что такое MTHFR?
Метилентетрагидрофолатредуктаза, или MTHFR, представляет собой фермент, играющий роль в метаболизме гомоцистеина и фолата. Ген MTHFR, кодирующий этот фермент, может быть мутантным, что может либо препятствовать способности фермента нормально функционировать, либо полностью инактивировать его.
19411 • • 14.11.2019
У людей есть две копии гена MTHFR, каждый из которых наследуется от одного из родителей. Мутации в них могут быть гетерозиготными или гомозиготными.
- Существует два распространенных типа или варианта мутации MTHFR: C677T и A1298C.
- Мутации в генах MTHFR встречаются примерно у 25% людей испаноязычного происхождения и у 10–15% людей европейского происхождения.
- Эти мутации часто приводят к высоким уровням гомоцистеина в крови, что может способствовать возникновению многих патологий, таких как:
- · врожденные пороки развития;
- · сердечно-сосудистые заболевания;
- · глаукома;
- · расстройства психического здоровья;
- · определенные виды рака.
В этой статье мы рассмотрим мутации MTHFR более подробно, включая сопряженные с ними состояния, диагностику и способы лечения. Мы также обсудим, как мутации MTHFR могут повлиять на беременность.
- Состояния, связанные с мутацией MTHFR
- Мутации в гене MTHFR могут повлиять на метаболизм метионина и гомоцистеина, что может привести к неблагоприятным последствиям для здоровья.
- Состояния, которые исследователи связывают с мутациями гена MTHFR, включают:
- · гомоцистинурия — термин, обозначающий аномально высокий уровень гомоцистеина в крови или моче;
- · атаксия — неврологическое состояние, которое влияет на координацию;
- · периферическая невропатия — неврологическое состояние, при котором повреждаются нервы;
- · микроцефалия — состояние, при котором голова новорожденного меньше, чем обычно;
- · сколиоз – аномальное искривление позвоночника;
- · анемия, что означает, что у человека низкий уровень эритроцитов;
- · сердечно-сосудистые заболевания, такие как тромбозы, инсульты и инфаркт миокарда;
- · расстройства психического здоровья и поведения, такие как депрессия и синдром дефицита внимания и гиперактивности (СДВГ).
- Возможные признаки и симптомы
Симптомы различаются как у отдельных людей, так и в зависимости от типа мутации. Люди обычно не знают, что они являются носителями мутации MTHFR, если они не испытывают серьезных симптомов или не проходят генетическое тестирование.
Наличие одной или двух мутаций MTHFR может немного увеличить уровни гомоцистеина, присутствующего в крови или моче. Это состояние называется гомоцистинурия.
Гомоцистеин — это аминокислота, которую организм вырабатывает, расщепляя пищевые белки. Высокий уровень гомоцистеина может повредить кровеносные сосуды и привести к образованию тромбов. Люди с высоким уровнем гомоцистеина обычно имеют низкий уровень витамина B-12.
- Симптомы гомоцистинурии вследствие мутаций MTHFR включают в себя:
- · патологии свертывания крови;
- · задержки развития;
- · припадки;
- · микроцефалию;
- · тромбы;
- · плохую координацию;
- · онемение или покалывание в руках и ногах.
- Диагностика
Врач может заподозрить, есть ли у человека мутации гена MTHFR, просмотрев его историю болезни, учитывая его текущие симптомы и выполнив медицинский осмотр. Врач может порекомендовать провести анализ крови, чтобы проверить уровень гомоцистеина.
Хотя можно идентифицировать мутацию гена MTHFR с помощью генетического тестирования, такие организации, как Американская кардиологическая ассоциация и Американский конгресс акушеров-гинекологов, не рекомендуют проводить скрининг на распространенные варианты генов MTHFR.
Лечение
Медикаментозное лечение не всегда необходимо при наличии вариантов MTHFR. Изменения в питании и образе жизни зачастую способны компенсировать любые возникающие в результате дефициты питательных веществ.
- Однако людям может потребоваться медицинское лечение, если у них высокий уровень гомоцистеина. Врач может предложить людям с повышенным уровнем гомоцистеина принимать следующие добавки:
- · фолиевая кислота;
- · витамины В-6 и В-12;
- · метионин;
- · 5-метилтетрагидрофолат (5-MTHF).
- Диета
Ген MTHFR регулирует, как организм обрабатывает фолат, аминокислоту в животных белках, и другие витамины группы В. Употребление пищи, богатой фолатом, может помочь купировать симптомы, вызванные мутациями MTHFR.
- Богатые фолатом продукты включают в себя:
- · животные и растительные белки, такие как говядина, яйца, бобы, горох и чечевица;
- · овощи, в том числе шпинат, спаржа, брюссельская капуста и брокколи;
- · фрукты, такие как банан, дыня, папайя и авокадо;
- · обогащенные зерна, которые включают в себя рис, муку и зерновые.
Фолиевая кислота — это синтетическая форма фолата, которая доступна в качестве добавки. Однако люди, которые имеют мутацию MTHFR, могут получить больше пользы от приема добавок, содержащих 5-MTHF, который является активной формой фолата.
- Исследователям еще предстоит определить преимущества добавок фолиевой кислоты для лечения людей с мутациями MTHFR.
- Влияние на беременность
- Женщины с положительным результатом теста на мутацию MTHFR могут иметь повышенный риск преэклампсии, повторных выкидышей или рождения ребенка с врожденными нарушениями.
- Мета-анализ 2015 года, основанный на 54 исследованиях с контролем случаев заболевания, выявил убедительные доказательства того, что женщины с генотипом MTHFR C677T имеют более высокий риск преэклампсии.
- По словам исследователей, эта мутация присутствовала в 1,371 раза чаще среди женщин с преэклампсией.
- В исследовании, проведенном в 2018 году, ученые обнаружили, что преждевременное прерывание беременности чаще встречалось у женщин с мутацией MTHFR C677T, чем у женщин с мутацией MTHFR A1298C.
- Исследователи также отметили сильную связь между вариантами MTHFR и следующими исходами беременности:
- · рождение детей с расщелиной губы или неба;
- · рождение детей с сердечно-сосудистыми нарушениями;
- · рождение детей с нарушениями мочевыделительной системы;
- · повторные выкидыши;
- · преждевременный разрыв плодных оболочек ( ПРПО);
- · преждевременная отслойка нормально расположенной плаценты.
- Информационный центр по генетическим и редким заболеваниям заявляет, что исследования показывают: женщины с двумя вариантами гена C677T могут иметь более высокий риск рождения ребенка с дефектом нервной трубки.
Дефекты нервной трубки относятся к нарушениям позвоночника, головного или спинного мозга, которые присутствуют при рождении. Они обычно развиваются в течение первого месяца беременности.
Факторы риска
Люди наследуют одну копию гена MTHFR от каждого из своих родителей, что означает, что у каждого есть два гена MTHFR. Мутации могут происходить в одном или обоих генах.
- Наличие родителя или близкого родственника с мутацией гена MTHFR может увеличить риск наследования этого варианта человеком.
- Люди, чьи оба родителя являются носителями мутации, имеют повышенный риск гомозиготной мутации MTHFR.
- Когда обратиться к врачу
- Человек должен обратиться к врачу, если он испытывает симптомы дефицита фолата или витамина B-12, которые могут включать:
- · усталость;
- · одышка;
- · запор;
- · потеря аппетита или непреднамеренная потеря веса;
- · мышечная слабость;
- · онемение, покалывание или боль в руках или ногах;
- · головокружение или потеря равновесия;
- · язвы во рту;
- · изменения настроения.
- Человек также должен обратиться к врачу, если у него есть симптомы анемии, которые могут включать:
- · утомляемость;
- · слабость;
- · затруднения дыхания;
- · головокружение;
- · головные боли;
- · аритмия.
- Прогноз
Наличие мутации MTHFR по-разному влияет на разных людей. Люди с одним или несколькими вариантами MTHFR могут иметь более высокие, чем обычно, уровни гомоцистеина в крови или моче.
Хотя текущие исследования выявили связи между вариантами MTHFR и многочисленными заболеваниями, необходимы дополнительные исследования, чтобы определить точное влияние этих генных мутаций на здоровье.
Люди могут поговорить со своим врачом о преимуществах и рисках генетического тестирования. Однако большинство организаций здравоохранения не рекомендуют генетическое тестирование, если человек не испытывает значительных проблем со здоровьем.
Источник: evogenlab.ru
Авторы: Консультанты:
Метилентетрагидрофолатредуктаза (MTHFR). Выявление мутации C677T (Ala222Val)
Метилентетрагидрофолатредуктаза (MTHFR). Выявление мутации C677T (Ala222Val)
- Название гена — MTHFR
- OMIM — *607093
- Локализация гена на хромосоме — 1p36.22
- Функция гена
- Ген MTHFR кодирует белок МТНFR (метилентетрагидрофолатредуктазу) – внутриклеточный фермент, участвующий в превращении гомоцистеина в метионин при наличии кофакторов – пиридоксина (витамина В6), цианокобаламина (витамина В12) – и субстрата – фолиевой кислоты.
- Генетический маркер C677T
- Участок кодирующей последовательности ДНК гена MTHFR, в котором может происходить замена основания цитозина (С) на тимин (T) в положении 677, обозначается как генетический маркер C677Т.
- Следовательно, изменяются и биохимические свойства фермента, в котором происходит замена аминокислоты аланина на валин в сайте связывания фолата.
- Ala222Val – обозначение замены аминокислоты аланина на валин в аминокислотной последовательности белка MTHFR.
- Возможные генотипы
- Встречаемость в популяции
- Встречаемость минорного Т-аллеля в европейской популяции составляет 30 %.
- Ассоциация маркера с заболеваниями
- Общая информация об исследовании
МТНFR (метилентетрагидрофолатредуктаза) – внутриклеточный фермент, участвующий в превращении гомоцистеина в метионин при наличии кофакторов – пиридоксина (витамина В6), цианокобаламина (витамина В12) – и субстрата – фолиевой кислоты. Активность данного фермента может снижаться в результате нуклеотидных замен в кодирующем его гене. Вследствие этого нарушается метаболический путь превращения гомоцистеина и его содержание в плазме крови увеличивается.
Замены нуклеотидов в гене MTHFR – одна из наиболее распространенных причин гипергомоцистеинемии.
Известно около десяти вариантов гена, влияющих на изменение функции кодируемого им фермента. Наиболее изучен вариант, в котором цитозин (С) в позиции 677 заменяется на тимин (T). Такой полиморфизм гена MTHFR обозначается как C677Т.
Следовательно, изменяются и биохимические свойства фермента, в котором происходит замена аминокислоты аланина на валин (A222V) в сайте связывания фолата, что сопровождается повышением уровня гомоцистеина в крови.
У носителей генотипа Т/Т наблюдается термолабильность (чувствительность к повышению температуры) фермента и снижение его активности до 35 % от среднего значения.
Носительство термолабильного Т-аллеля достаточно широко распространено у представителей европейской расы (присутствует у 30 %). Реже всего он встречается у африканцев (у 7 %), и среди них не отмечено ни одного Т/Т-генотипа, в то время как среди европейцев носителями Т/Т-генотипа является примерно 10 % населения.
Изменение С677Т в структуре гена MTHFR ассоциировано с различными заболеваниями, для которых характерен широкий спектр клинических симптомов: сердечно-сосудистые заболевания, дефекты развития плода, колоректальная аденома и рак молочной железы и яичников, умственное и физическое отставание в развитии, депрессии, диабет и др.
У носителей генотипа Т/Т в 3 раза повышен риск сердечно-сосудистых заболеваний: высокий уровень гомоцистеина увеличивает вероятность атеросклероза и тромбоза.
Накапливаясь в организме, он повреждает внутреннюю стенку артерий, что приводит к разрывам эндотелия.
На поврежденную поверхность осаждаются холестерин и кальций, образуя атеросклеротическую бляшку, вследствие чего просвет сосуда сужается, а иногда закупоривается.
Гипергомоцистеинемия может явиться причиной таких осложнений беременности, как преждевременная отслойка нормально расположенной плаценты, прерывание беременности, хроническая внутриутробная гипоксия плода и преэклампсия. Риск их развития повышается в сочетании с другими формами тромбофилии (мутация протромбина, фактора V Лейден и др.).
Дефицит MTHFR способствует тератогенному (повреждающему плод) и мутагенному (повреждающему ДНК) действию из-за нарушения процессов метилирования ДНК (с ним также связана гомозиготность по аллелю 2756G гена метионинсинтазы).
У носителей аллеля Т во время беременности, как правило, наблюдается дефицит фолиевой кислоты, что может приводить к дефектам развития нервной трубки у плода.
В сочетании с генотипом GG по измененному варианту гена MTRR (66A-G-полиморфизм) Т/Т-генотип ассоциирован с более чем двукратным повышением риска хромосомных аномалий и нарушений развитий нервной системы у плода. Исследования показали, что приём фолиевой кислоты стабилизирует термолабильный фермент, нейтрализуя тем самым его негативное действие.
Роль тромбофилии у пациенток с неудачами ВРТ в анамнезе
Во всем мире бесплодие является социально и экономически значимой проблемой. В отдельных регионах России частота бесплодия достигает 15-20%, этот показатель является критическим в связи с низким уровнем рождаемости и воспроизводства населения [8, 9].
В 2013 г. Министерством здравоохранения РФ были опубликованы «Научные платформы медицинской науки», в которых одним из приоритетных направлений развития медицины на период до 2025 г. было обозначено «Репродуктивное здоровье» [7].
Для лечения бесплодия применяются самые современные методы, количество циклов вспомогательных репродуктивных технологий (ВРТ) ежегодно увеличивается.
Однако, несмотря на интенсивное развитие эмбриологии и репродуктивной медицины, показатели эффективности программ экстракорпорального оплодотворения (ЭКО) из года в год остаются стабильными и не превышают 33% [2].
Примерно у 30% супружеских пар наблюдаются повторные неудачные попытки ЭКО.
На исход программ ВРТ влияют многие факторы, в последние годы активно обсуждается роль тромбофилии в структуре ранних имплантационных потерь [6, 12, 22].
Однако необходимо отметить, что результаты исследований, посвященных этой проблеме, зачастую противоречивы, что, возможно, обусловлено этнической неоднородностью, клинической гетерогенностью обследуемых групп больных, малочисленностью выборок и некорректным подбором контрольной группы.
В некоторых работах [1, 4, 13, 15] теоретическая связь между тромбофилиями и повторными неудачами ЭКО нашла клиническое подтверждение. Однако в литературе [21] также встречается противоположная точка зрения.
Единственный систематический обзор и метаанализ, оценивающий связь между тромбофилиями и исходами программ ВРТ, был опубликован M. Di Nisio и соавт. [14] в 2011 г.
Отмечено, что частота мутаций Лейдена V фактора гемостаза у женщин с неудачами ЭКО в анамнезе значимо выше, чем у фертильных пациенток и у женщин, забеременевших после ЭКО (ОШ=3,08; 95% ДИ 1,77-5,36).
Связь между остальными тромбофилическими состояниями и неудачами ВРТ доказать не удалось. Однако авторы метаанализа отметили очень высокую степень гетерогенности между исследованиями (75%) [14].
Кохрановские обзоры по проблеме неудачных исходов программ ЭКО и тромбофилий отсутствуют.
В настоящее время нет единого мнения о роли тромбофилии в патогенезе имплантационных потерь и бесплодия, нет и единых подходов к ведению пациенток с тромбофилиями во время подготовки к протоколу ЭКО.
Ввиду неоднозначности результатов исследований клинические рекомендации медицинских обществ в разных странах различаются, а в России, к сожалению, отсутствуют.
В связи с этим выявление особенности структуры наследственной и приобретенной предрасположенности к тромбофилии у пациенток с повторными неудачами ВРТ в анамнезе представляет собой научный и практический интерес.
Цель настоящего исследования — оценить роль наследственной и приобретенной тромбофилии в наступлении беременности с помощью программ ВРТ. Основные задачи:
1. Оценить частоту и структуру наследственной и приобретенной тромбофилии у женщин с двумя и более неудачными попытками ЭКО в сравнении с пациентками, у которых беременность наступила с первой попытки ЭКО, и женщинами со спонтанно наступившей беременностью.
2. Выявить формы тромбофилий, наиболее неблагоприятные для успешной реализации программ ВРТ.
В настоящее исследование были включены 144 пациентки, проходившие лечение бесплодия с помощью ВРТ в ООО «Евроклиник» в период с 2010 по 2012 г. Основная группа представлена 94 женщинами с двумя или более неудачными попытками ЭКО в анамнезе.
В группу сравнения вошли 50 пациенток, которые забеременели с первой попытки ЭКО. Контрольную группу составили 30 женщин со спонтанно наступившей, физиологически протекавшей беременностью, завершившейся родами в срок.
Критериями включения в данную группу являлось отсутствие тромбозов, инфекционных заболеваний и акушерской патологии в анамнезе.
Средний возраст пациенток всех групп был сопоставим и составил в основной группе 33,2±4,5 года, в группе сравнения — 31,0±3,6 года, в контрольной группе — 30,6±3,6 года.
Продолжительность бесплодия была значимо выше в группе пациенток с двумя и более неудачными попытками ЭКО в анамнезе — 6,1±3,7 года (у пациенток, забеременевших с первой попытки ЭКО, — 3,1±1,9 года).
Достоверных различий по исходному уровню ФСГ и этиологии бесплодия между основной группой и группой сравнения выявлено не было. Среднее число неудачных попыток ЭКО в основной группе составило 3,2 (от 2 до 10).
Все пациентки, проходившие лечение бесплодия с помощью ЭКО, были обследованы по стандартной схеме в соответствии с приказом Минздрава №67, действовавшим на момент проведения лечения. Патология эндометрия у пациенток с многократными неудачными попытками ЭКО в анамнезе была исключена по данным гистероскопии и гистологического исследования эндометрия.
Все пациентки, участвующие в данном исследовании, были обследованы на наследственную и приобретенную тромбофилии.
Во всех трех группах была изучена частота встречаемости четырех основных маркеров наследственной тромбофилии: аллельные варианты С677Т гена метилентетрагидрофолатредуктазы (MTHFR), маркер G20210A гена протромбина (FII), полиморфизм G1691A гена V фактора гемостаза (FV), аллельный вариант –675 4G/5G гена ингибитора активатора плазминогена (PAI-1), в основной группе и группе сравнения проводилось расширенное обследование на наследственную тромбофилию, рассматривались 14 показателей.
Статистический анализ осуществлялся с помощью программы Statistica for Windows 7.0 («Stat Soft Inc.»). При проведении попарного сравнения частот аллелей и генотипов между анализируемыми группами использовали критерий &khgr;2 с поправкой Йетса или точный критерий Фишера. Различие двух сравниваемых величин считали статистически значимыми при достижении р
Генетический полиморфизм, ассоциированный с риском развития тромбофилии
Тромбофилия (от греч. trhombos – сгусток и philia – склонность) – состояние системы крови, которое проявляется в нарушении гемостаза, склонности к развитию рецидивирующих сосудистых тромбозов (преимущественно венозных) различной локализации и часто возникает в
связи с беременностью, после хирургического вмешательства, травмы или физического пере-
напряжения. Заболевание обусловлено генетической (у 30–50 % с тромботическим состоянием) или приобретенной патологией клеток крови, а также дефектами свертывающей системы крови. При этом тромбофилия еще не тромбоз, но при этом наблюдается готовность организма к тромбообразованию.
Генетическая предрасположенность к тромбофилии может реализоваться через генетические дефекты как свертывающей, так и противосвертывающей (антикоагулянтной и фибринолитической) систем крови, при которых имеется готовность к тромбозу. Тромбозом называют прижизненное образование сгустков крови в просвете сосудов или в полостях сердца.
Тромбозы играют одну из главных ролей в развитии заболеваний сердечно-сосудистой системы, которые стоят на первом месте в инвалидизации и преждевременной смертности жителей экономически развитых стран. На сегодняшний день доля этих заболеваний в структуре смертности составляет 40–60 % (примерно 14 миллионов смертей ежегодно).
При этом продолжающийся рост заболеваемости и поражение людей все более молодого возраста делает сердечно-сосудистые заболевания (ССЗ) важнейшей медико-социальной проблемой здравоохранения. Показатели смертности от ССЗ в России в 2–4 раза выше, чем в западноевропейских странах, США, Канаде, Австралии, и в настоящее время наблюдается тенденция к росту смертности.
Согласно статистике последних лет, опубликованной на сайте http://www.critical.ru, в структуре смертности от ССЗ в российской популяции 85,5 % приходится на долю ИБС (46,8 %) и мозгового инсульта (38,7 %). Наследственная тромбофилия играет важную роль в структуре акушерских и гинекологических осложнений, таких как потери плода, привычное невынашивание беременности, повторные неудачи при ЭКО, тромбоэмболии у беременных.
Еще одной важной проблемой является назначение оральных контрацептивов. Оральная контрацепция является одним из самых надежных способов предотвращения нежелательной беременности, но сопряжена с риском тромбозов. Показано, что сама по себе гормональная контрацепция незначительно повышает риск тромбозов, но при носительстве определенного генотипа опасность резко возрастает.
Согласно Национальным медицинским критериям приемлемости методов контрацепции 2012 года и четвертой редакции «Медицинских критериев приемлемости для использования методов контрацепции», разработанных ВОЗ в 2009 году, для предотвращения тромбозов и тромбоэмболических осложнений при приеме оральных контрацептивов рекомендовано выявление тромбогенных мутаций (F2 – протромбиновая мутация, F5 – фактор Лейдена).
Генетический анализ позволяет выявить полиморфизмы генов факторов системы гемостаза, обусловливающих их аномальный синтез или нарушение функциональной активности.
Это помогает оценить риски развития сердечно-сосудистой патологии и акушерско-гинекологических осложнений, тромбоэмболии, венозных и артериальных тромбозов.
Скрининг генетических особенностей тромбофилий помогает на раннем этапе выявить группу риска и внести соответствующие коррективы в тактику ведения пациентов.
Показания к назначению профиля «генетика тромбофилии»:
- случаи наследственной тромбоэмболии в семье;
- случаи тромбоза в анамнезе:
- единичный до 50 лет;
- повторные;
- в любом возрасте при наличии семейного анамнеза;
- необычной локализации (портальные, брыжеечные, мозговые вены);
- непонятной этиологии после 50 лет;
- применение гормональной контрацепции или гормональной заместительной терапии у женщин, которые имеют тромбозы в анамнезе, родственников первой степени родства с диагностированной наследственной тромбофилией или семейный анамнез тромбоэмболических осложнений
- осложненный акушерский анамнез;
- женщины, планирующие беременность, которые имеют тромбозы в анамнезе, родственников первой степени родства с диагностированной наследственной тромбофилией или семейный анамнез тромбоэмболических осложнений;
- ситуации высокого риска:
массивные хирургические вмешательства;
длительная иммобилизация;
- профилактика тромботических осложнений у больных, имеющих злокачественные новообразования.
Полиморфизм гена коагуляционного фактора II(G20210A) (протромбин)
Настоящая мутация наследуется по аутосомно-доминантному типу и в гетерозиготном состоянии встречается у 2,3 % людей в общей популяции.
Клинически ее можно заподозрить по постоянно высокому уровню протромбина в плазме крови (у 87% носителей превышает 115%).
Риск развития тромбоза у носителей гетерозиготной аномалии повышается в 3 – 5 раз и более значительно при использовании оральных контрацептивов.
- Показания к назначению: инфаркт миокарда, гиперпротромбинемия, тромбоэмболические состояния в анамнезе, невынашивание беременности, фетоплацентарная недостаточность, внутриутробная гибель плода и задержка развития плода, отслойка плаценты, перед большими полостными операциями.
- Биологический материал для анализа: цельная кровь, стабилизированная ЭДТА
- Полиморфизм гена коагуляционного фактора V (акцелератор-глобулин) (Лейден)
Мутация наследуется по аутосомно-доминантному типу. Аллельная частота от 2,9 до 7,8% (в среднем 4,4%). FVL (Лейден) увеличивает риск преимущественно венозного тромбоза у лиц моложе 40 – 45 лет в 3 – 4 раза, особенно на фоне беременности, послеродового периода, длительной иммобилизации, больших хирургических вмешательств и приема оральных контрацептивов.
- Показания к назначению: венозный тромбоз, тромбоэмболические заболевания в молодом возрасте, рецидивирующие тромбоэмболии, сердечно-сосудистые заболевания в семейном анамнезе, невынашивание беременности, фетоплацентарная недостаточность, внутриутробная гибель плода и задержка развития плода, отслойка плаценты, перед большими полостными операциями, прием пероральных контрацептивов.
- Биологический материал для анализа: цельная кровь, стабилизированная ЭДТА
- Полиморфизм гена коагуляционного фактора VII(G10976A) (проконвертин)
Вариант 353Gln (10976A) приводит к понижению производительности (экспрессии) гена фактора VII и является защитным фактором в развитии тромбозов и инфаркта миокарда. Распространенность данного варианта в европейских популяциях составляет 10-20%.
При исследовании пациентов со стенозом коронарных артерий и инфарктом миокарда обнаружено, что наличие мутации 10976A приводит к понижению уровня фактора VII в крови на 30% и 2-х кратному понижению риска инфаркта миокарда даже при наличии заметного коронарного атеросклероза.
- Показания к назначению: оценка риска инфаркта миокарда и фатального исхода при инфаркте миокарда, тромбоэмболические заболевания в анамнезе.
- Биологический материал для анализа: цельная кровь, стабилизированная ЭДТА
- Полиморфизм гена коагуляционного фактора XIII(G103T) (фибриназа)
Фибриназа — энзим, ответственный за конечную стадию в каскаде коагуляции крови человека.
Фактор 13A катализирует сшивание мономеров фибрина через образование связей между аминокислотами, приводя к образованию фибрина, обладающего значительной механической силой и резистентностью к протеолитической деградации плазмином.
Кроме своей основной функции в свертывании крови, фактор 13 играет роль в стабилизации клеточной поверхности мембран. Распространенность мутантного аллеля Т в европейской популяции около 20%. Считается, что эта мутация ведет к изменению кинетики сшивания фибрина — фибриновые волокна более тонкие и уменьшается их пористость.
Биологический материал для анализа: цельная кровь, стабилизированная ЭДТА
Полиморфизм гена коагуляционного фактора I(G455A) (фибриноген)
При повреждении кровеносных сосудов фибриноген переходит в фибрин — основной компонент кровяных сгустков (тромбов).
Мутация -455А бета фибриногена (FGB) сопровождается повышенной производительностью (экспрессией) гена, что приводит к повышенному уровню фибриногена в крови (до 130%) и увеличивает вероятность образования тромбов. Распространенность данного варианта в европейских популяциях составляет 5-10%.
- Показания к назначению: повышенный уровень фибриногена плазмы, повышенное кровяное давление, повышенная вероятность тромбообразования, инсульт.
- Биологический материал для анализа: цельная кровь, стабилизированная ЭДТА
- Полиморфизм гена ингибитора активатора плазминогена PAI-1(5G/675/4G)
Один из основных компонентов тромболитической плазминоген-плазминовой системы, PAI-1 ингибирует тканевый и урокиназный активаторы плазминогена. Вариант 4G приводит к повышенной экспрессии гена и, следовательно, к повышенному уровню PAI-1 в крови. Следовательно, тромболитическая система заторможена и риск тромбообразования возрастает.
Гомозиготный вариант 4G полиморфизма –675 4G/5G является фактором риска развития различных тромбозов и инфаркта миокарда (при носительстве риск повышается в 4.5-раза, у мужчин — в 6 раз), также приводит к повышению риска тромбообразования во время беременности и, как следствие, повышению риска нарушения функции плаценты и невынашивания беременности.
Распространенность гомозиготной формы данного варианта в европеоидных популяциях составляет 5-8%.
- Показания к назначению: портальный тромбоз и другие тромбоэмболические состояния в анамнезе, инфаркт миокарда, ИБС, повышение концентрации ингибитора активатора плазминогена в крови, мутация ITGB3, ожирение.
- Биологический материал для анализа: цельная кровь, стабилизированная ЭДТА
- Полиморфизм гена тромбоцитарного рецептора (интегрина) ITGA2(C807T)
Данный рецептор, влияет на адгезию тромбоцитов на коллагене и других субстратах, а также участвует в реорганизации межклеточного матрикса. Генетические варианты GPIa могут приводить к изменению кинетики адгезии тромбоцитов.
Вариант C807T встречается с частотой 5,7% и является маркером кардиоваскулярных заболеваний и артериальным тромбоэмболиям. Исследование 177 пациентов с инфарктом миокарда (средний возраст 57 лет) и 89 здоровых доноров показало значительную разницу в распределении частот вариантов 807C и 807T между двумя группами.
Более высокая частота гомозиготного варианта 807T у пациентов соответствовала почти 3-кратному повышению риска инфаркта
- Показания к назначению: cемейный анамнез ранней ИБС, инфаркт миокарда, тромбоэмболические состояния в анамнезе, постангиопластические тромбозы, неонатальная тромбоцитопения, антитромботическая терапия аспирином.
- Биологический материал для анализа: цельная кровь, стабилизированная ЭДТА
- Полиморфизм гена тромбоцитарного рецептора (интегрина) ITGB3(T1565C)
Ген тромбоцитарного рецептора фибриногена (ITGB3) кодирует бета-3 субъединицу интегрин-комплекса поверхностного рецептора тромбоцитов GPIIb/IIIa, известную также как гликопротеин-3а (GPIIIa). ITGB3 участвует в межклеточной адгезии и сигнализации.
ITGB3 обеспечивает взаимодействие тромбоцита с фибриногеном плазмы крови, что приводит к быстрой агрегации (склеиванию) тромбоцитов. Мутация 33P GPIIIa способствует повышенной склонности тромбоцитов к агрегации, что увеличивает риск развития сердечно-сосудистых заболеваний.
У пациентов с этим вариантом часто отмечается пониженная эффективность аспирина как дезагрегантного препарата. Частота встречаемости мутации 33P в европейских популяциях составляет 8-15%.
Показания к назначению: Семейный анамнез ранней ИБС, инфаркт миокарда, тромбоэмболические состояния в анамнезе, постангиопластические тромбозы, неонатальная тромбоцитопения, антитромбозная терапия аспирином.
Биологический материал для анализа: цельная кровь, стабилизированная ЭДТА

Оставить комментарий